预测和测量蛋白质聚集,是生物制药配方中的一个重大难题。Lisa Newey-Keane博士描述了一种新型分析方法,可以方便地研究蛋白质的聚集。
由于在药物研发总体经费支出中,生物分子研究工作所占的比重越来越大,因此分析测试在迅速发展的生物制药行业受到广泛关注。这些分子开发不仅成本高昂,而且受到严格监管,所以急需更适合、更严谨的分析测量方法。很多业内人士都提到,分析瓶颈是一个很令人担心的问题,可能会限制药物的开发。
与小分子药物不同,蛋白质制剂是非合成或非结晶的,且本质上是不均匀的。正因为如此,对生物疗法的纯度和效力做出判定,要比对非生物分子复杂得多。例如,杂质来源繁多,包括以聚集体、错误折叠构象,或是以完全变性结构形式存在的生物分子。因此,用于保证和控制质量并提供预配方和配方必要数据所需的分析技术与制药业中的用于小分子药物的分析技术完全不同。这种复杂性和多变性,不仅给制造商,同样也给监管机构带来了许多新的挑战。
挑选合适的候选分子会在其它分析中涉及各种物理化学测试过程,以排除那些有可能成为下游“问题分子”的分子。其中一个需要回答的最重要的问题是,这些分子将会在配方中有怎样的表现。而值得关注的重要领域是蛋白质聚集体,以及聚集可能引发的免疫反应。监管机构已经明确表达了对直径为0.2微米至2微米的蛋白质聚集体造成的潜在免疫原性的关注,但现有的粒径测定技术,尚不足以提供这一范围的量化数据。它们可以让你知道有这种粒径的粒子存在,但无法确定存在的数量。被应用于马尔文阿基米德系统的谐振质量测定(RMM )技术能弥补这一缺陷,因为它不仅可以进行粒径测量,更重要的是能对直径为50纳米 - 5微米的粒子进行计数。
技术简介
共振质量测量主要是依靠一个可以检测质量变化的机械共振结构。质量增加或减少,可以使结构的共振频率上升或下降。由于可对频率进行非常精确的测定,这就为测量质量提供了基础。为了测量悬浮在液体上的微小颗粒的质量,共振器内置了微流体通道。当悬浮颗粒通过该结构时,它会改变共振器的整体质量,由此改变其共振频率。如图1所示,颗粒在位置1时进入共振器。当颗粒到达共振器末端的位置2时,对共振频率造成的偏移达到最大值。而当颗粒在位置3退出时,共振频率又恢复到基准线。
通过测量共振频率对基准线的偏移,可以实现对粒子质量的测量。对于具有上浮力的微粒,如油滴(见下文),则可以观测到相反的效果,共振频率会相对于基准线发生正偏移。
采用共振质谱测量非常小的颗粒,需要使用自身质量很小的共振器。在马尔文阿基米德系统中,MEMS(微机电系统)传感器能满足这一要求。每个传感器芯片包括一个微流体网络和一个微小的悬臂,以一个特定的频率发生共振。悬臂中内置一个微流体通道。当仪器中的流体系统将样品推送经过通道时,悬臂的共振频率会发生变化。共振频率的变化通过激光测量,先聚焦到悬臂的顶端,然后将其发送到一个分离光电二极管探测器。
每个粒子穿过传感器都会引起一次共振频率的变化,从而得到对样品中单个颗粒浮力质量精准的测量,无论这个数据是正是负。通过这样的测量,可以计算出粒子的质量、粒径(等效球)以及表面积。同时也可对样品浓度、密度、体积和多分散性进行整体测量。
蛋白质聚集体的定量测量
起初,蛋白质聚集体处于二聚体水平,此后直径一路攀升到数十微米,高于这一范围上部的聚集体通常采用流量式显微镜来测量。共振质量测量可应用于低于流式显微镜测量范围的领域,包括那些粒径在亚微米至几微米、以及不易通过其他方法评估定量评估测量的粒径。这也是免疫原性的影响之处,以及新的监管要求关注的地方。
图3(a)为 4 µL配制缓冲液中,亚微米级IgG蛋白聚集体的粒度分布状况。
使用RMM测量得出,粒径大于300纳米的聚集体浓度为每毫升4×106。因为测量是基于质量的,粒度分布可以用形成每种聚集体(图3(b))的蛋白质分子(已知质量的)数量来表示。图3(c)中列出的是,提高剪切应力一段时间后,对蛋白质样品的测量结果,并图示出了在整个实验过程中,从300nm到1μm范围内聚集体的浓度在增长。这种尺寸的聚集体出现10倍的增加,大致对应一条聚集体级联,而亚微米聚集体的浓度与压力下制剂质量的不好有关。
检测污染物
蛋白质制剂分析中另一个流行的课题是硅油,它通常作为润滑剂,存在于盛制剂的注射器和容器中。硅油常常会混入制剂中,形成与聚集体大小接近的油滴。但主要问题不是生物相容性,因为硅油滴通常被认为是安全的。更大的问题在于,在某些测量方法中,油滴会被误认为是蛋白聚集体,因此有可能影响结果的准确性。
RMM可以通过浮力测量将硅油滴与蛋白质聚集体区分开来。例如,在图4中,密度大于悬浮缓冲液的聚集体,是用频率轨迹中的负峰值来表示。
硅油滴的密度一般比缓冲液的密度低,会在频率轨迹上形成正峰值,这是因为它们的存在降低了传感器的整体质量,从而提高传感器的共振频率。每一组都提供了单独的分布情况。
今日技术
常规分析仪器使用过程中, RMM技术应用和推行成功至为关键的原因,在于它解决了蛋白质聚集测量中的关键粒度范围这一问题。同样重要的是,在处理小剂量贵重材料时,只需100 μL粘度达到100 cP的样品,且无需进行样品制备,即可进行测量。
由于能对50纳米至5微米尺寸范围内的颗粒进行检测并精确计数,以及对浮力质量、干质量和大小进行可靠测量,共振质谱测量成为蛋白特性鉴定极具吸引力的方案。有关配方和稳定性的定量信息,可被转化为对效能及其稳定性的信息。目前,RMM已经被用于生物制剂早期开发阶段,对聚集体进行检测和量化,这实现了“发现越早,代价越小”的理念。
马尔文公司全新的生物科学开发计划
在传统模式下,要将一种分析仪器推向市场,并使其成为完善的最终产品,往往要耗时数年。但这种模式却完全不适用于生物制药部门,因为它往往只能回答时过境迁的问题。处于生物制药研究最前沿的研究人员,需要能解决当前问题的分析工具;而对供应商的挑战,则在于需要对未知领域进行预测,在这些领域,快速变化的分析和监管要求不断考验相关参与者。因此有必要了解什么是可以测量的,什么样的测量结果可以提供质量方面的有价预测信息,并预见未来所需要的测量。
马尔文通过创建生物科学开发计划,助力生物科学行业的飞速发展。该计划旨在跟上生物制药技术快速的发展步伐,并肩负起作为分析仪器制造商的责任,即针对迅速发展的分析和监管挑战,快速提供令人信服的解决方案。获得成功的关键是以高度自信、开放的态度,展开高层次技术开发合作,并建立灵活的技术和产品开发流程,对确认的分析需求保持绝对的专注。
尽管生物科学开发计划是马尔文组织机构的一个组成部分,其运营却是在华盛顿特区附近的工厂中开展。该计划由马尔文公司首席技术官E Neil Lewis 博士负责,他领导着一支由科学家、工程师和业务开发人员组成的专家小组。这些成员虽然分处各地,却又紧密联系于马尔文核心团队之中。他们专注于生物制药行业的要求,尤其是有关配方和产品开发的生物化学和生物物理表征的需求。
这一对市场反应迅速、经费充足且目标明确的计划,将会促进生物制药企业、技术创新者和领先学术机构之间的密切合作。通过建立这种互惠互利的关系,马尔文可以实时了解新兴产业的要求,并作出快速响应,生物制药部门则可以尽早介入,并帮助设计它所亟需的前沿技术。该项合作的第一项成果,是达成了将马尔文阿基米德系统推向市场的协议。随着技术的进一步发展,今年会有完全成熟的产品推出。
欲了解有关马尔文生物科学发展计划的进一步信息,敬请联系E. Neil Lewis博士
[图片]
图1:在流体中测量粒子质量

图2:共振质谱测量仪器的配置(马尔文阿基米德系统)
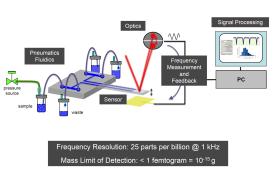
图3:(自左至右)(a),(b)及(c):利用马尔文阿基米德系统进行聚集体检测

图4:区分蛋白质聚集体和受污染硅油液滴能力的展示