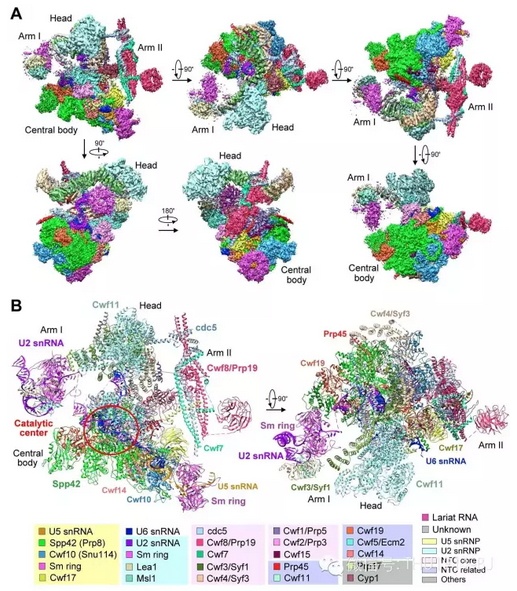
第一篇文章报道了通过单颗粒冷冻电子显微技术(冷冻电镜)解析的酵母剪接体近原子分辨率的三维结构,第二篇文章在此结构的基础上进行了详细分析,阐述了剪接体对前体信使RNA执行剪接的基本工作机理。清华大学生命学院闫创业博士、医学院博士研究生杭婧和万蕊雪为两篇文章的共同第一作者。
这一研究成果具有极为重大的意义。自1993年RNA剪接的发现以来,科学家们一直在步履维艰地探索其中的分子奥秘,期待早日揭示这个复杂过程的分子机理。施一公院士研究组对剪接体近原子分辨率结构的解析,不仅初步解答了这一基础生命科学领域长期以来备受关注的核心问题,又为进一步揭示与剪接体相关疾病的发病机理提供了结构基础和理论指导。
清华大学将于近期召开新闻发布会,介绍这项重大的科研成果。
另据《赛先生》对施一公的一篇专访介绍,“这项研究成果的意义很可能超过了我过去25年科研生涯中所有研究成果的总和!”施一公振奋地表示:“我此前以通讯作者身份在《科学》、《自然》和《细胞》上发表的文章总共接近50篇,但我觉得这次的意义特别重大!”
6月24日,Nagai研究组的一篇论文于《自然》网站在线发表,其工作将剪接体所涉及的一个中心复合物tri-snRNP的分辨率提高到了5.9个埃米,一度引起轰动。而此前人类对基因剪接体的认识精度只有29个埃米。1埃米为10-10米,即把1米分成十亿份,其之微小可以想见,因此Nagai的最新工作被称为近原子尺度的结构研究。
而施一公团队此次得到的结果不仅将精度由5.9个埃米提高到了3.6个埃米,而且其解析对象是真正的剪接体,而不是Nagai团队所取得的参与剪接体组装过程的复合物,从而第一次在近原子分辨率上看到了剪接体的细节。
对于施一公团队的最新成果,很多同行给出了非常高的评价:将受诺奖考虑。
一直以来,研究蛋白质结构有三种主要方法:X射线晶体衍射、核磁共振以及单颗粒冷冻电子显微镜(冷冻电镜)。而施一公所采用的冷冻电镜技术在过去两年里取得了革命性的进展,一方面是它的照相机技术,一方面是其软件分析的图像处理技术,尤其是前者的进步大幅提高了冷冻电镜的解析能力。
施一公说:“如果没有冷冻电镜技术,就完全不可能得到剪接体近原子水平的分辨率。”
尤为幸运的是,早在冷冻电镜技术还远未成势的2007年,清华大学就在上述三种方法中选择了重点发展冷冻电镜技术,如今清华拥有世界最大的冷冻电镜系统。施一公把他和同事们当年卓有远见的选择归于“幸运”,他说“如果没有冷冻电镜肯定做不到今天的结果,而当年确实没想到冷冻电镜会出现飞跃性的进展。”
“幸运”远不止是当年选对了技术。除了仪器的进步,在施一公看来,他们能领先竞争对手的主要原因是拥有极为成熟的样品处理方法。“也就是说如何让蛋白质服服帖帖、性质稳定,成为适合结构解析的样品”,他半开玩笑地说“这是我们的独门绝招,这个绝招即便写出来,别人不在我的实验室做上一两年也很难理解或吃透,因为这是师傅带徒弟一点点积累起来的。”
除了靠谱的仪器、技术和学生,施一公说,“胆量”给了他们最大的惊喜。“本来我们的样品不是最理想的状态,学生有点不敢试,我说不妨上一下试试,最多就是不成功,只要有15埃的分辨率就很好了,结果算出来竟然有3.6埃。我们在今年整个4月份里做计算,那一个月突破连连、都跟做梦似的!”





