成像
今年,生命科学的成像领域打破了过去的壁垒,科学家们通过显微镜学方法越来越深入的观察到了生命组织。
Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances.
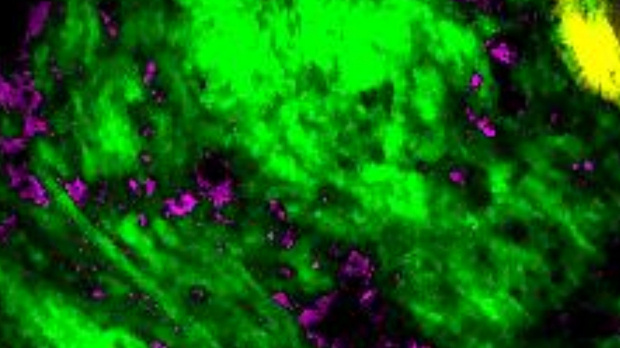
在过去的十年里,一种称作为体内振动光谱成像(vibrational spectroscopicimaging)的技术一直被用来捕捉一些活体组织中蛋白质、脂类、核酸和其他分子的活动。尽管这一技术可在无需荧光标记的条件下显影组织,但它仍然太慢而无法适用于大多数的研究和临床应用。
10月30日,Purdue大学的科学家们报告称,他们利用体内振动光谱成像技术大大提高了收集图片的速度(从分到秒)。新技术最关键的改进是不再需要收集分子振动信号的光谱仪。取而代之的是,这一改进的技术在光子进入组织前会对其进行颜色编码。
该研究的通讯作者 Ji-Xin Cheng 说:“我们的想法是在将光子发送到组织前,用不同的兆赫频率进行颜色编码。通过这样的方式,我们能够在几十微妙内收集漫射光子,并通过编码频率和光颜色之间的一一对应检索光谱。”
Whole-animal functional and developmental imaging with isotropic spatial resolution. Nature Methods.
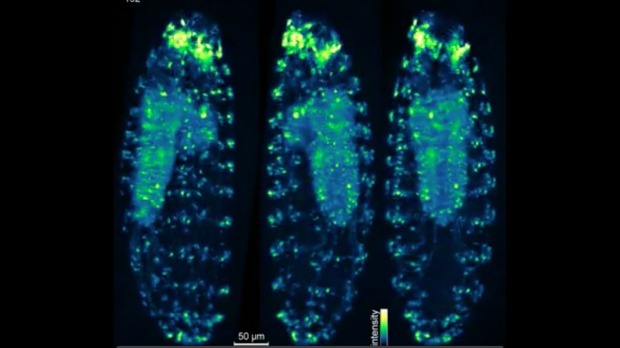
同一个月,发表在《Nature Methods》上的一项研究中,霍华德休斯医学研究所Philipp Keller领导的研究小组发明的一款新型显微镜让科学家们能够更加清晰、全面的观察活体动物的生物过程。
这款显微镜能够产生完整的、不透明生物体的图像,包括斑马鱼或果蝇的胚胎,在三个维度都有足够的分辨率,每个细胞都能展现出明显的结构。更重要的是,它能够观察到胚胎发育过程中细胞的移动,还能够监测大脑活动。研究人员用它记录了果蝇神经系统发育的过程,最终共有10,000个细胞。
光遗传学
All-Optical Interrogation of Neural Circuits. Journal of Neuroscience .
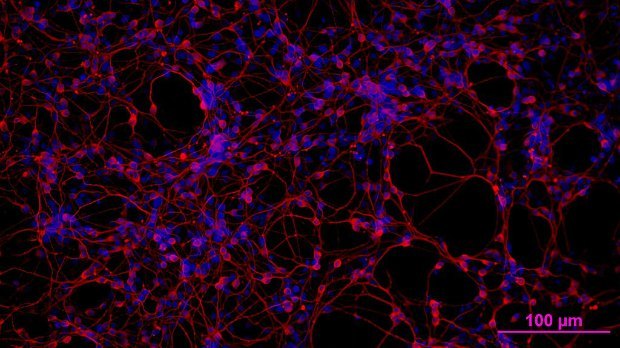
今年11月,MIT的Edward Boyden和斯坦福大学的Karl Deisseroth因他们在光遗传学领域的工作获得了表彰。光遗传学技术是指通过光线来操控神经元,科学家们一直在不断的改进这一技术。
本月前,在芝加哥举行的神经科学学会会议上,Deisseroth等人提出了全光电生理学(all-optical electrophysiology)的升级版。哈佛大学Adam Cohen和他的团队开发出了一种reporter,当引入到细胞中去时,在电压发生改变的情况下会发出红外线。Cohen与Boyden一起,将电压指示器与一种响应蓝光的膜通道一起导入到了细胞中,这使得研究人员能够用蓝光开启细胞,用红外线记录它们的活动。
Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science.
今年6月,发表在《科学》杂志上的一项研究中,研究人员在海藻中发现了一种紫红质通道蛋白(channelrhodopsin),与先前开发的工程通道相比,它能够更快地抑制神经元活动。科学家们还开发出了一种对在光遗传学控制下神经元作出即时反馈的方法,维持它们的活性在一个理想的状态。这一“神经恒温器”(neuro thermostat)可在24小时内控制细胞的firing rate常数。
单细胞分析
Droplet Barcoding for Single-Cell Transcriptomics Applied to Embryonic Stem Cells. Cell
Highly Parallel Genome-wide Expression Profiling of Individual Cells Using Nanoliter Droplets. Cell
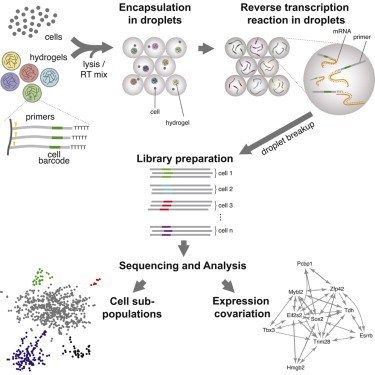
近年来,单细胞分析蓬勃发展,研究成果不断涌出,技术也越来越精准。今年,通过单细胞分析,科学家们鉴定出了一个新的细菌们,检测了小鼠肠道内最珍贵的细胞类型。5月,发表在《细胞》杂志上的两项研究使单细胞转录组学有了一个相当大的飞跃,并行检测的细胞数量从约100增加到了几千。
哈佛大学的Marc Kirschner和Steve McCarrol实验室开发出了一些高通量技术,能够在样本进入到搅拌器中去之前,快速、轻松、廉价地赋予每个细胞独特的遗传条形码。研究小组希望他们的技术将能够帮助生物学家们更深入地发现和分类机体中的细胞类型,绘制出大脑一类复杂组织中的细胞多样性图谱,更好地了解干细胞分化,以及获得更多有关疾病遗传学的认识。
两个研究小组各自开发了一些方法利用微珠将大量不同的DNA条形码同时传送到几十万纳米大小的液滴中。两种方法都利用了微流体装置来将细胞和微珠一起装入这些液滴中。这些液滴是在一个小型装配线上生成,沿着一根头发宽的槽道流动。微珠条形码附着到每个细胞的一些基因上,因此科学家们可以一批次测序所有的基因,追踪每个基因的来源细胞。
CRISPR
我们熟知的基因编辑工具CRISPR不断带来新的研究成果,在许多研究人员利用CRISPR的同时,其他一些人则专注于改进这一技术。
Photoactivatable CRISPR-Cas9 for optogenetic genome editing. Nature Biotechnology.

6月15日,发表在《Nature Biotechnology》上的一项研究中,科学家们结合CRISPR与光遗传学构建出了一种系统:一种光激活的新型Cas9核酸酶使得研究人员能够在空间和时间上更好地控制RNA引导的核酸酶的活性。
研究人员通过首先将Cas9蛋白分成两个失活的片段构建出了paCas9。随后他们让每个片段连接一个光控开关蛋白Magnet。当受到蓝光照射时,两个Magnet蛋白结合到一起,分开的Cas9片段随之结合重建出了RNA引导的Cas9核酸酶活性。重要的是,这一过程是可逆的:当切断光线时,paCas9核酸酶会再度分裂,核酸酶活性终止。
Rationally engineered Cas9 nucleases with improved specificity. Science.
Cas9酶是基因编辑系统中一个非常关键的组成部分,而脱靶效应一直是CRISPR技术需要克服的重大技术问题。11月30日,发表在《科学》杂志上的一项研究中,麻省理工学院-哈佛医学院Broad研究所CRISPR大神张锋的研究小组又取得了一项突破性的成果。研究人员通过创建了3个新版本的Cas9酶大大降低了CRISPR/Cas9系统的脱靶效应;有效改善了这一技术的最大局限性之一。
In vivo genome editing using Staphylococcus aureus Cas9.Nature.

4月1日,发表在《自然》杂志上的一项研究中,张锋研究小组还鉴别出了一种更小的Cas9核酸酶版本。最常使用的Cas9酶源自化脓性链球菌(SpCas9),因太大而无法装入到腺病毒载体中。这项研究中介绍了一种来自金黄色葡萄球菌的Cas9核酸酶(saCas9),它比SpCas9小25%,从而为腺病毒的包装问题提供了一个解决方案。并未参与这项研究的杜克大学的 Charles Gersbach 说:“真正让人兴奋的是saCas9在体内真的能发挥作用。”
Epigenome editing by a CRISPR-Cas9-based acetyltransferase activates genes from promoters and enhancers. Nature Biotechnology.
同月6日,Gersbach和同事们也在《Nature Biotechnology》发表了他们的研究成果。研究人员结合一种组蛋白乙酰转移酶与Cas9构建出了一种表观遗传编辑器。他们破坏了Cas9切割DNA的能力,转而利用它作为一种自动引导装置到达基因组中的正确位点,并通过组蛋白乙酰化来启动基因。
备注:本文部分内容参考自生物通网站。