2015年,在国家食品药品监督管理总局的领导下,药品审评中心(以下简称药审中心)紧紧围绕“改革审评制度,解决审评积压,提高审评质量,完善审评体系”,不断推进各项工作,切实维护和促进公众健康。根据国家食品药品监督管理总局有关工作要求,现将《2015年度药品审评报告》予以发布。
一、2015年受理与审评情况
2015年,药审中心全年接收新注册申请8211个(以受理号计,下同)。与既往年度接收注册申请的比较情况见图1。
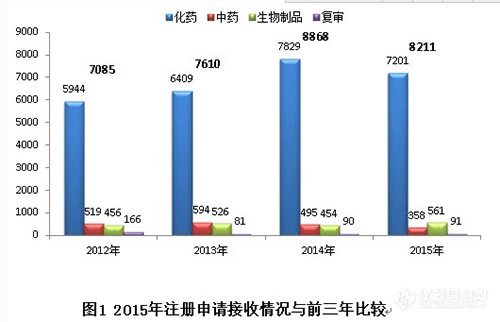
2015年接收注册申请数量较2014年有所回落,但仍处于高位。其中化药和中药接收量有所下降,生物制品接收量有所增加。近年来,化药注册申请的接收量约占各年度接收总量的85%。
2015年,药审中心全年完成审评的注册申请共9601个,超过年度接收量1390个,实现了完成量大于接收量。其中建议批准临床4676个,建议批准上市391个,建议批准补充申请1183个,建议批准进口再注册143个,建议各类不批准2208个,另有企业撤回等情况的注册申请1000个。(超过年度接受量中72%是来自企业撤回。)
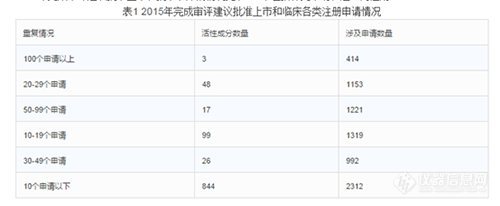
2015年完成审评建议批准上市和批准临床的情况见表1(不包括补充申请和进口再注册)。
(一) 2015年化药受理和审评情况
1.注册申请的接收情况
2015年,化药各序列注册申请接收情况如下:
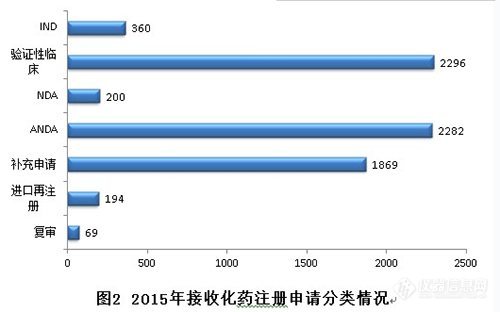
2015年,新接收化药注册申请共7270个。其中验证性临床、ANDA、补充申请三类注册申请占化药全年接收量的88.6%。
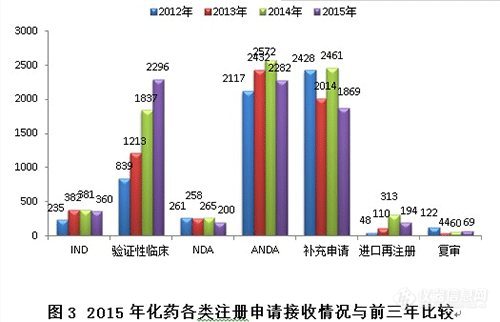
与前三年比较,验证性临床接收量逐年大幅增加,ANDA和补充申请下降较为明显,具体见图3。
2.IND各治疗领域接收注册申请情况
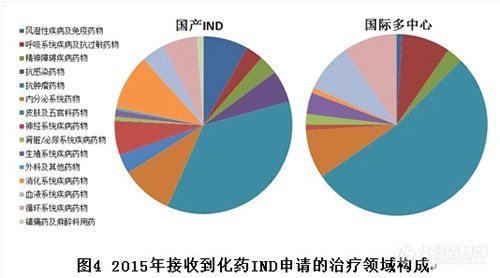
国产IND申报数量较多的治疗领域有:抗肿瘤药物、消化系统疾病药物、内分泌系统药物、风湿性疾病及免疫药物。国际多中心(含进口IND)申报数量较多的治疗领域主要集中在抗肿瘤药物。(国际多中心抗肿瘤药物占比目测超过50%,2016年新开的临床试验大多也是肿瘤药,各肿瘤医院开展临床热情与BE试验基地开展情况相比可谓是冰火两重天)
对比国产和进口IND,相同的申报热点是抗肿瘤领域,不同的是国内IND申报较多的风湿性疾病及免疫药物、消化系统疾病药物、神经系统药物、抗感染药物等领域,几乎没有进口IND申报。
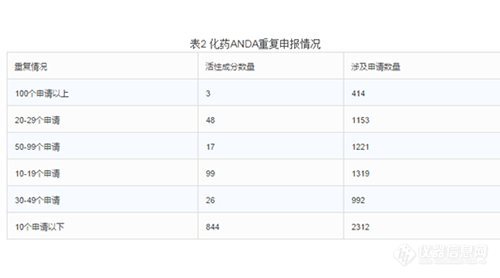
3.仿制药重复申报的情况
截至2015年底,待审的化药ANDA申请共7411个,占待审任务总量的42.9%,涉及活性成分1027个。重复申报较严重的有94个活性成分(待审任务量均在20个受理号以上),涉及注册申请3780个,占化药ANDA总任务量的51%。其中相同活性成分待审任务超过100个的有埃索美拉唑钠、恩替卡韦、法舒地尔,其中埃索美拉唑钠和恩替卡韦两个活性成分2015年的新申请量仍位列前茅。(埃索美拉唑钠针剂至今仍没有一家获批)。
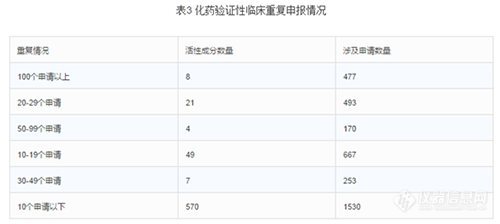
截至2015年底,待审的化药验证性临床申请共3590个,占待审任务总量的20.8%,涉及活性成分660个。重复申报较严重的有40个活性成分(待审任务量均在20个受理号以上),涉及注册申请1393个,占化药验证性临床总任务量的38.8%。其中相同活性成分待审任务超过50个的有沃替西汀、阿普斯特、阿考替胺、曲格列汀、阿伐那非、阿法替尼、阿齐沙坦、卡格列净。(阿齐沙坦片2015年至2016年2月的获批临床受理号数76个,3.1类化药申报获批临床的制剂第一位)
4.审评完成情况
2015年中心完成化药审评8514个(以受理号计),具体情况见下表。
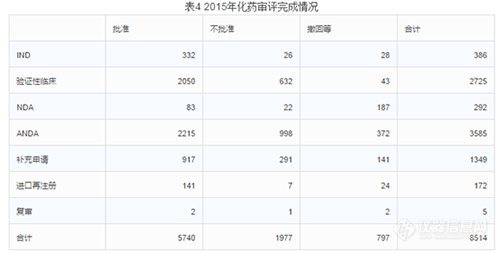
有明确审评结论的注册申请中,批准结论5740个,不批准结论1977个,总体不批准率为25.6%。(不批准率最高的是ANDA,不批准率高达28%;其次是验证性临床,不批准率23%;第三是22%的补充申请。整体撤回率9%,撤回率最高的是NDA,高达64%;其次是复审,40%撤回率;第三是进口再注册的14%撤回率。整体批准率67%,批准最高的是IND,86%的批准率;其次是进口再注册,82%;第三是验证性临床,75%的批准率。)
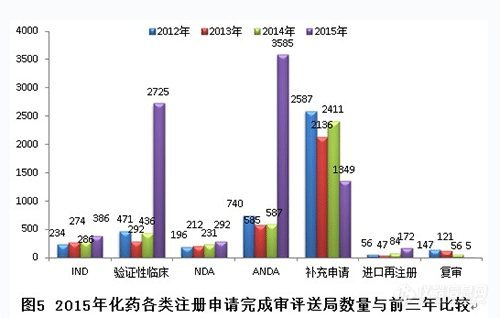
图5显示,2105年验证性临床和ANDA(申请临床试验)两个任务序列完成量大幅增加,IND、NDA和进口再注册两个任务序列的完成量平稳增加,补充申请通道完成量下降明显。
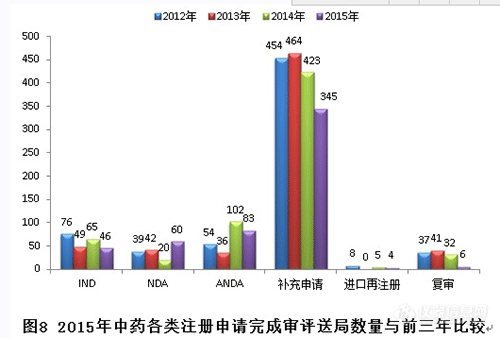
(二) 2015年中药受理和审评情况
1.注册申请的接收情况
2015年,中药各序列注册申请接收情况如下:(补充申请数量排名第一。)
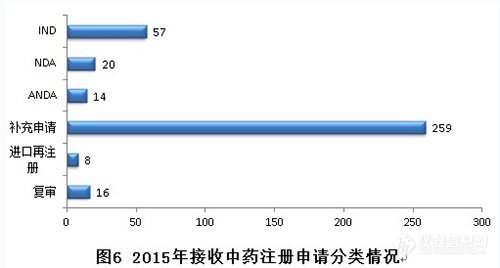
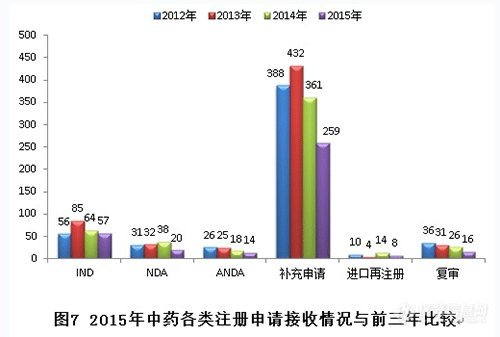
2015年,新接收中药注册申请共374个,各类注册申请接收情况与前三年比较见下图:
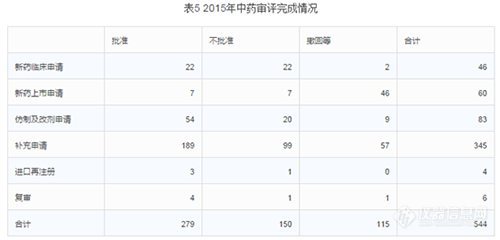
2.审评完成情况
2015年中心完成中药审评544个,具体情况见下表。其中批准的仿制及改剂型均为遗留品种。(整体不批准率28%,不批准率最高的是新药临床申请,不批准率高达48%;其次是补充申请,不批准率29%;第三是25%的进口再注册。整体撤回率21%,撤回率最高的是新药上市申请,高达77%;其次是复审和补充申请,17%撤回率。整体批准率51%,批准最高的是进口再注册,75%的批准率;其次是复审,67%;第三是仿制及改剂申请,65%的批准率。)
(三)2015年生物制品受理和审评情况
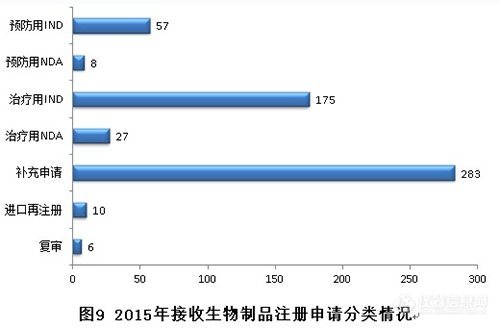
1. 注册申请的接收情况
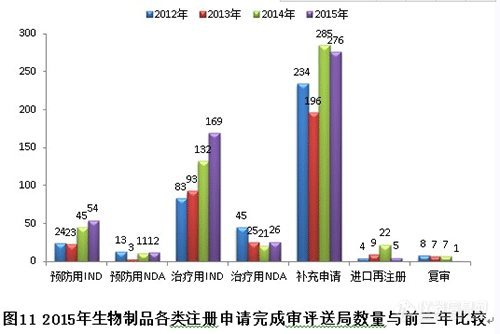
2015年,生物制品各序列注册申请接收情况如下:(补充申请数量也是排名第一,治疗用IND申请历史新高。)
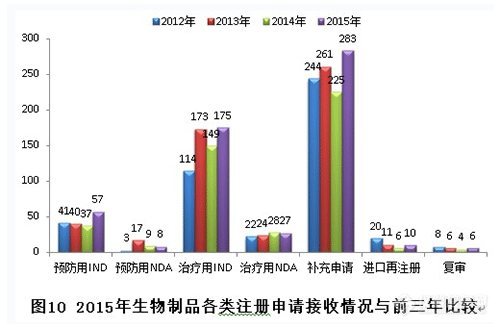
新接收生物制品注册申请共566个,各类注册申请接收情况与前三年比较见下图:
新接收生物制品注册申请共566个,各类注册申请接收情况与前三年比较见下图:
2.审评完成情况
2015年中心完成生物制品审评543个,具体情况见下表。(生物制品完成的审评数量和中药基本一直。生物制品整体不批准率15%,不批准率最高的是治疗用NDA,不批准率高达35%;其次是预防用NDA,不批准率33%;第三是14%的治疗用IND。整体撤回率16%,撤回率最高的是预防用IND,撤回率22%;其次是治疗用IND,18%撤回率;第三是撤回率17%的预防用NDA。整体批准率69%,比化药和中药的批准率要高。批准最高的是进口再注册和复审,100%的批准率,数量也较少,前者5个,后者1个;其次是补充申请,73%的批准率。)
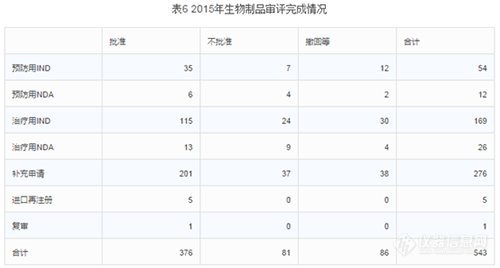
各类注册申请完成审评情况与前三年比较见下图:
二、2015年批准的重要品种
2015年,药审中心及时完成了多个涉及重大公共卫生领域、具有重要社会价值品种的审评工作,为患者获得最新治疗手段提供了可能性,也为患者用药可及性提供了重要保障。
1.Ebola疫苗:我国自主研发的重组埃博拉疫苗,也是全球首个2014基因突变型埃博拉疫苗。药审中心按“特别审评程序”完成了该疫苗临床试验申请的审评,获得了世界卫生组织(WHO)、西非国家和国际社会的一致好评。
2.口服I型III型脊髓灰质炎减毒活疫苗(人二倍体细胞):WHO全球消灭脊髓灰质炎战略免疫规划推荐的常用疫苗,药审中心按照“特别审评程序”完成审评并批准了该疫苗的注册上市,为实现WHO全球消灭脊髓灰质炎战略免疫规划和相关疫苗的可获得性奠定了基础。
3.肠道病毒71型灭活疫苗: 我国自主研发的1类新药疫苗,用于刺激机体产生抗肠道病毒71型(EV71)的免疫力,预防EV71感染所致的手足口病。药审中心按“特殊审评程序”完成了该疫苗审评并经总局批准上市,对有效降低我国儿童手足口病发病率和重症死亡率具有重要意义。
4.注射用阿糖苷酶α:目前全球唯一批准用于庞贝病的药物。庞贝病是一种进行性和致死性代谢性疾病,病情严重,特别是婴儿型,病情进展快,死亡率高,目前国内缺乏有效治疗手段。该产品按孤儿药评价要求及时完成审评并获准在我国进口上市,为我国庞贝病患者提供了一种有效的治疗药物。(我国的孤儿药审评机制终于有了实例)
5.门冬氨酸帕瑞肽注射液:目前全球唯一批准的库欣氏病对因治疗药物。库欣病属于罕见疾病,对于不能手术或手术不能治愈的患者数量更少,且患者常伴多种合并症,死亡率高,目前国内尚无有效的治疗药物。该品种在我国的进口上市,为此类患者提供新了的治疗手段。
6.醋酸阿比特龙片:全球首个选择性、不可逆甾体类抑制剂,属于全新作用机制的前列腺癌治疗药物,用于去势抵抗性转移性前列腺癌(mCRPC)。前列腺癌是男性最常见的恶性肿瘤之一,近年来我国前列腺癌的发病率呈上升趋势,一旦化疗失败,缺乏有效的治疗手段,同时,还有部分患者不能耐受化疗的毒性,因此对该类患者缺乏有效治疗手段。该品种在我国上市,将填补现有mCRPC患者治疗手段的不足。
7.阿昔替尼片:批准用于进展期肾细胞癌的成人患者。主要针对既往接受一种酪氨酸激酶抑制剂或细胞因子治疗失败的进展期肾细胞癌的成人患者,该产品的进口上市,将为晚期肾癌患者带来更多的治疗选择。
8.贝伐珠单抗注射液:批准用于非小细胞肺癌的一线治疗。相对于单纯接受化疗治疗,以该品种为基础的一线治疗可显著延长患者的无疾病进展生存期。该品种新扩展新适应症的批准,为肺癌患者带来了新的治疗手段。
9. 聚乙二醇修饰干扰素:我国第一个国产上市的聚乙二醇(PEG)修饰干扰素品种,其及时完成审评并批准上市,打破了国外进口同类产品垄断中国市场的局面。
10.聚乙二醇化重组人粒细胞刺激因子注射液:批准用于非骨髓性癌症患者在接受易引起临床上显著的发热性中性粒细胞减少症发生的骨髓抑制性抗癌药物治疗时,降低以发热性中性粒细胞减少症为表现的感染的发生率。两家国内企业获批该产品上市,可提高患者对该药物的可获得性。
11.蒺藜皂苷胶囊:批准用于中风病中经络(轻中度脑梗死)恢复期中医辨证属风痰瘀阻证者。系针对中医药优势病种开发的中药有效部位新药,将为此类疾病患者增加用药选择空间。
(获批的新药充分体现了临床必需用药优先审评审批,且与美国、欧盟尽量同步上市的精神。)





