近日,中国科学院生物物理研究所柳振峰研究组、章新政研究组与常文瑞/李梅研究组通力合作,联合攻关,通过单颗粒冷冻电镜技术,在3.2埃分辨率下解析了高等植物(菠菜)光系统II-捕光复合物II超级膜蛋白复合体(PSII-LHCII supercomplex)的三维结构。该项研究工作于5月18日在《自然》(Nature)期刊作为长篇主题论文(Article)在线发表。
光合作用为地球上几乎所有生命体提供赖以生存的物质和能量,基于结构的光合作用机理研究不仅具有重要的理论意义,同时也将为解决能源、粮食、环境等问题提供具有启示性的方案。植物光合作用的原初反应是从光系统II开始的,光系统II是由25个以上蛋白质亚基以及众多色素和其它辅因子组成的超大膜蛋白-色素复合物。该复合物中包含了天线系统、反应中心系统以及一个能在常温常压下裂解水释放氧气的放氧中心。解析植物光系统II神秘而复杂的精细结构将有助于理解该超分子机器的工作原理,也是结构生物学研究领域中多年来一直追求的热点和难点课题,并且是光合作用研究领域中众所期盼的一个超大膜蛋白-色素复合体三维结构。
在对高等植物光系统II超大膜蛋白复合物样品的分离制备和晶体学研究方法长期探索的基础上,该研究团队及时引进并应用单颗粒冷冻电镜技术,通过联合三个课题组的优势科研力量并发挥各自的特长,团结奋战,协作攻关,以最高的效率在较短的时期内取得了突破性进展,高质量完成了该项具有高度挑战性的国际前沿研究课题。
此次所解析的菠菜PSII-LHCII超级复合物的总分子量约1.1兆道尔顿(megadalton)(1,100 kDa),形成了一个同质二聚体的超分子体系。每个单体中包含了25个蛋白亚基、105个叶绿素分子、28个类胡萝卜素分子和众多的其它辅因子。研究结果首次揭示了这一高度复杂的超分子体系的总体结构特征和各亚基的排布规律。
在每个菠菜PSII核心复合物的外周,结合了主要捕光复合物LHCII三聚体,以及分子量分别为29 kD和26 kD的次要捕光复合物CP29和CP26。该项工作首次解析了CP29的全长结构和CP26的结构,并发现了这三个不同外周捕光复合物与核心复合物之间相互装配和识别的机制和位点。在准确指认了外周捕光复合物与核心复合物界面上的三个小亚基的基础上,合理解释了它们在介导二者之间装配以及稳定超级复合物方面的作用。
外周捕光复合物为光系统II核心复合物提供激发能,而二者之间的能量传递途径多年来一直未能得到精确解析。在对菠菜PSII-LHCII超级复合物内部高度复杂的色素网络进行深入分析的基础上,首次揭示了LHCII、CP29以及CP26向核心天线复合物CP43或CP47传递能量的途径。同时,还对在光保护过程中发挥作用的潜在能量淬灭位点进行了定位。研究结果对于进一步在分子水平理解PSII-LHCII超级复合物中的能量传递时间动力学和光保护机理具有重要意义。
该工作由生物物理所三个课题组共同完成,博士研究生魏雪鹏和助理研究员苏小东为该项工作的共同第一作者。该研究工作得到了中科院B类先导“生物超大分子复合体的结构、功能与调控”专项、科技部“973”重大科学问题导向项目“光合作用与‘人工叶片’ ”和自然科学基金的共同资助,研究员柳振峰和章新政得到了国家“青年千人计划”的资助和支持。该项工作得到生物物理所生物成像中心、 国家蛋白质科学中心(上海)、生物物理所蛋白质科学研究平台等有关工作人员的大力支持和帮助。
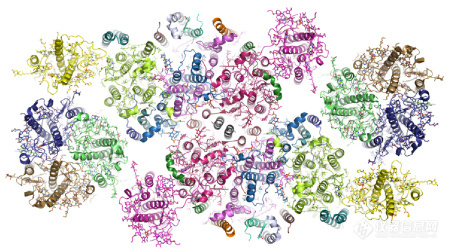
菠菜PSII-LHCII复合物整体结构(顶视图)





