聚合酶链式反应(Polymerase Chain Reaction,PCR)是一种体外核酸扩增系统,其原理类似DNA分子的天然复制过程,是将在待扩增的DNA片段和与其两侧互补的两个寡聚核苷酸引物,经变性、退火和延伸若干个循环后,DNA扩增 2n 倍。该技术已成为分子生物学中一种有助于DNA克隆及基因分析的必需工具。
要先对PCR目的序列长度要有大致估计:
第一步:找到Primer3站点,你不用记住这个站点,但是要记住“Primer3”这个词,然后打开GOOGLE首页,输入Primer3,跳出来的第一个项目就是了“Primer3 Input 0.4.0(primer3-web/htdocs/input-040.htm)”网址:http://frodo.wi.mit.edu
第二步:贴上模板序列。进入Primer3站点,可以看到一个引物设计的界面。(附件:Word文档里有图)在“Paste source sequence below(5'->3'…..”下面的大空框里将你的模板序列粘帖进去。注意是5'->3'方向的,数字或者空格都没关系,软件会自动过滤。
第三步:重要参数设定。首先是“Product Size Ranges”,如果你不希望软件给你随便做的话,首先要调整的就是这个参数。默认的参数实际上是从100到1000,这个你得自己改,如果你希望产物的大小符合你的预期,尽可能把范围改小,比如:480~500,具体看情况调整。第二个参数是“Primer Size”,默认值一般可以用,但是,当你用熟了这个软件,你自己就知道该怎么改了。第三个参数是“PrimerTm”这个和Primer Size差不多。
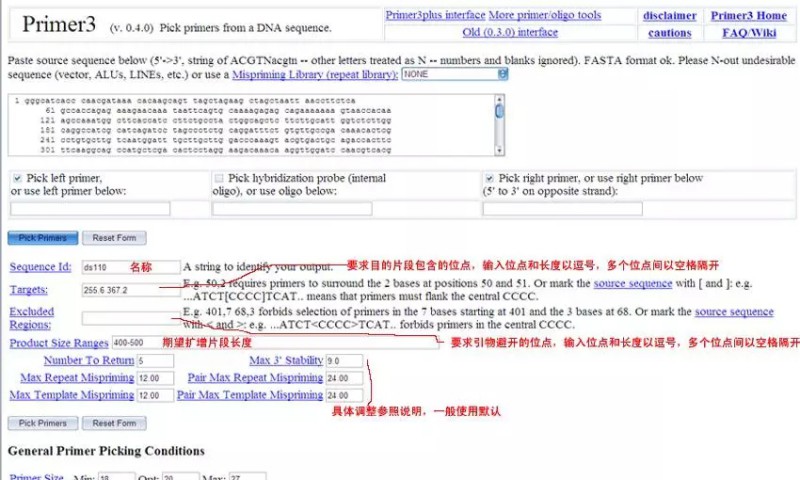
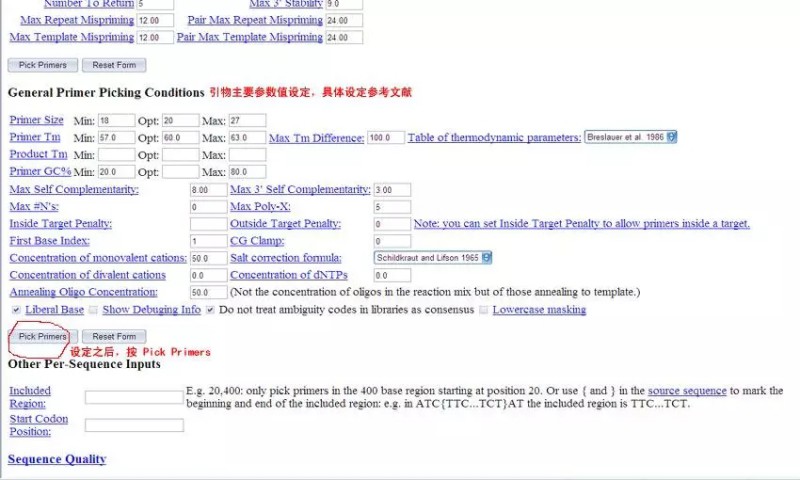
第四步:Pick primers:点一下这个按钮,符合你大小预期的primer就出来了,看看Primer3Output的界面,多么漂亮!你要的primer出来了,而且有primer在序列上的位置比对图,还要primer本身的信息,包括:位置、长度、Tm、GC含量、任何位置互补碱基数、3'端互补碱基数以及引物序列(注意:下游引物是5'->3'),还要看产物大小,两引物间任意互补碱基数,两引物间3'端互补碱基数等。如果引物尚在参数设定的范围内,但还不是最佳,将会给出警告。


第五步:引物设计检验:可以仅设计一向引物,只要在Pick left primer或者Pick right primer前面的勾勾掉一个就可以。也可以自己定义引物,放在Primer框里(注意:下游引物书写反向仍然是5'->3')如果符合设定条件,软件将对给出引物评分,同时给出警告信息,根据警告信息可以适当对自定义引物做些调整即可,警告信息也让你做实验的时候心中有数。对于文献发表的引物,最好检查一下,这样就可以避免被别人有意无意误导。至于RT-PCR所用引物,最好使得产物跨过内含子,这样避免潜在DNA对RT-PCR干扰。实际做引物的时候,要把内含子都去掉,仅将外显子序列放入源序列框中,并且,通过自定义引物设计的方法,使上下游引物分别全部或者部分落在不同外显子上。
至于设计出来引物的实际效果,根据我的经验,一般情况下都能做到PCR一次成功,也许随便那一段序列做引物也能达到很好的效果,但是不管怎么说,软件做引物可以让自己心中有数。
增加PCR特异性:
1.primers design
这是最重要的一步。理想的,只同目的序列两侧的单一序列而非其它序列退火的primer要符合下面一些条件:
1)足够长,18~24bp,以保证特异性,当然,不是说越长越好,太长的primer同样会降低特异性,并且降低产量;
2)GC%,40%~60%;
3)5'端和中间序列要多GC,以增加稳定性;
4)避免3'端GCrich,最后3个base不要有GC,或者最后5个有3个不要是GC(有人说:3'端最好是GC/CG/CC/GG。);
5)避免3'端的互补,否则,容易造成DIMER;
6)避免3'端的错配;
7)避免内部形成二级结构;
8)附加序列(RT site,Promoter sequence)加到5'端,在算Tm值时不算,但在检测互补和二级结构要加上它们;
9)使用兼并primer时,要参考密码子使用表,注意:生物偏好性,不要在3'端使用兼并primer,并使用较高的primer浓度(1μM~3μM);
10)最好学会使用一种design software,PP5,Oligo6,DNA star,Vector NTI,online design et al.
*primer的另一个重要参数是熔解温度(Tm)。这是当50%的primer和互补序列表现为双链DNA分子时的温度,Tm对于设定PCR退火温度是必需的。在理想状态下,退火温度足够低,以保证primer同目的序列有效退火。同时,还要足够高,以减少非特异性结合。合理的退火温度从55℃到70℃。退火温度一般设定比primer的Tm低5℃。
设定Tm有几种公式。有的是来源于高盐溶液中的杂交,适用于:小于18碱基的primer。
有的是根据GC含量估算Tm。确定primerTm最可信的方法是近邻分析法。这种方法从序列一级结构和相邻碱基特性预测primer的杂交稳定性,大部分计算器程序使用近邻分析法。
根据所使用的公式及primer序列不同,Tm会差异很大。因为,大部分公式提供一个估算的Tm值,所有退火温度只是一个起始点。可以通过分析几个逐步提高退火温度的反应以提高特异性。开始低于估算的Tm5℃,以2℃为增量,逐步提高退火温度。较高的退火温度会减少primer二聚体和非特异性产物形成。
为获得最佳结果,两个primer应具有近似的Tm值。primer对的Tm差异如果超过5℃,就会primer在循环中使用较低的退火温度而表现出明显的错误起始。如果两个primer Tm不同,将退火温度设定为比最低的Tm低5℃,或者,为了提高特异性,可以在根据较高Tm设计的退火温度先进行5个循环,然后在根据较低Tm设计的退火温度进行剩余循环。使得在较为严谨的条件下可获得目的模板部分拷贝。
stability of primers:定制primer标准纯度对于大多数PCR应足够。
primer产量受合成化学效率及纯化方法影响。定制primer以干粉形式运输。最好在TE重溶primer,使其最终浓度为100μM。TE比去离子水好,因为,水的pH经常偏酸,会引起寡核甘的水解。primer的稳定性依赖于储存条件。应将干粉和溶解的primer储存在-20℃。以大于10μM浓度溶于TE的primer在-20℃可以稳定保存6个月,但在室温(15℃到30℃)仅能保存不到1周。干粉primer可以在-20℃保存至少1年,在室温(15℃到30℃)最多可以保存2个月。
PCR检测微量感染因子时,容易因为污染的而导致各种问题,因此,进行PCR操作时,操作人员应该严格遵守一些操作规程,最大程度地降低可能出现的PCR污染或杜绝污染出现。
(1)划分操作区:
目前,普通PCR尚不能做到单人单管,实现完全闭管操作,但无论是否能够达到单人单管,均要求实验操作在三个不同的区域内进行,PCR的前处理和后处理要在不同的隔离区内进行:
①标本处理区,包括:扩增摸板制备;
②PCR扩增区,包括:反应液的配制和PCR扩增;
③产物分析区,凝胶电泳分析,产物拍照及重组克隆制备。
※各工作区要具有一定隔离,操作器材专用,要有一定方向性,如,标本制备→PCR扩增→产物分析→产物处理。
切记:产物分析区的产物及器材不要拿到其他两个工作区。
(2)分装试剂:
PCR扩增所需要的试剂均应在装有紫外灯的超净工作台或负压工作台配制和分装,所有的加样器和吸头需固定放于其中,不能用来吸取扩增后的DNA和其他来源DNA:
①PCR用水应为高压的双蒸水;
②引物和d-NTP用高压的双蒸水在无PCR扩增产物区配制;
③引物和d-NTP应分装储存,分装时应标明时间,以备发生污染时查找原因;
(3)实验操作注意事项:
尽管扩增序列的残留污染大部分是假阳性反应的原因,样品间的交叉污染也是原因之一。
因此:不仅要在进行扩增反应是谨慎认真,在样品的收集、抽提和扩增的所有环节都应该注意:
①戴一次性手套,若不小心溅上反应液,立即更换手套;
②使用一次性吸头,严禁与PCR产物分析室的吸头混用,吸头不要长时间暴露于空气中,避免气溶胶的污染;
③避免反应液飞溅,打开反应管时为避免此种情况,开盖前稍离心收集液体于管底。若不小心溅到手套或桌面上,应立刻更换手套并用稀酸擦拭桌面;
④操作多份样品时,制备反应混合液,先将dNTP、缓冲液、引物和酶混合好,然后分装,这样即可以减少操作,避免污染,又可以增加反应的精确度;
⑤最后加入反应模板,加入后盖紧反应管;
⑥操作时设立阴阳性对照和空白对照,即可验证PCR反应的可靠性,又可以协助判断扩增系统的可信性;
⑦尽可能用可替换或可高压处理的加样器,由于加样器最容易受产物气溶胶或标本DNA的污染,最好使用可替换或高压处理的加样器。如,没有这种特殊的加样器,至少PCR操作过程中加样器应该专用,不能交叉使用,尤其是PCR产物分析所用加样器不能拿到其它两个区;
⑧重复实验,验证结果,慎下结论。
什么是PCR实验灵敏度?
灵敏度指的是PCR扩增反应能够检测到目的基因最小值。研究结果表明,影响PCR扩增效率的因素,如,模板的复杂程度与完整性、引物纯度及其与模板结合效率、反应温度、DNA聚合酶的热稳定性与扩增性能、反应缓冲液的离子组成(主要指:阳离子)、反应优化剂等,均决定PCR实验检测灵敏度。在最佳扩增条件下,常规PCR反应能够检测到pg(10~12g)数量级目的基因。对于一个特定的目的基因,模板与引物通常都是已经限定好的因素。因此,选择什么样的PCR反应体系(包括:DNA聚合酶与反应缓冲液等)就是研究者提高PCR实验灵敏度的关键因素了。
与实验室自配PCR扩增体系相比,东盛Taq Mix对反应缓冲液中的成分进行优化,并加入了适当比例的反应增强剂(PCR Enhancer),提高DNA聚合酶热稳定性,显著降低模板二级结构对PCR扩增性能影响,使得DNA聚合酶处于最适活性状态,从而获得比自配体系更高检测灵敏度。即时反应体系中只有几个目的基因拷贝,也能轻松检测。
什么是PCR实验特异性?
特异性指的是在PCR扩增过程中,专一性扩增目的片段而非其他片段的性能。在PCR实验本身的灵敏度很高,且实验条件未充分优化的情况下,通常会在目的片段出现同时伴随有其他杂带,即,发生非特异性扩增现象。模板、引物性质及质量、反应条件控制等均会影响PCR扩增特异性。近年,研究结果表明,缓冲液品质(如,离子种类与组成,反应优化剂等)对保证PCR特异性扩增起着不可忽视的作用。一般缓冲液中调节氢键作用盐只有KCl,而东盛HSTMTaq Mix的缓冲体系通过反应优化剂以及KCl/(NH4)SO4盐离子体系平衡调节,显著提高PCR扩增特异性,降低背景。
PCR实验灵敏度与特异性是一对此长彼消特性,这也决定我们实验体系调节实际上就是需要找到适合实验灵敏度与特异性平衡点。由于PCR体系中的众多成分,使得组合较多,筛选工作繁杂。东盛基于灵敏度与特异性分别设计了PCR Mix和HS Taq Mix,帮您确定大平衡点,如果您需要更细致的平衡点,请选择相应的Mix Kit系列进行微调。
来源:易生物