
作为一对“强大”的技术,XL-MS和cryo-EM在结合运用中在共同弥补着各自的缺点不足。当cryo-EM图像中分子区域定义不太清晰明确时,XL-MS就会介入,提供关于特定氨基酸残基关键信息,从而可以识别蛋白质并准确推断蛋白质结构。以下,让我们详细探讨一下这两种技术的发展情况,以及它们如何共同推动结构蛋白质组学领域进入一个新的时代。
蛋白质结构:“组装机器的计划蓝图”
蛋白质及其复合物是生物细胞的生物“主力”,调节着细胞功能不可或缺的过程,如细胞生长、细胞死亡以及细胞生命周期的各个阶段。
“我喜欢将蛋白质结构与组装机器的蓝图进行比较,”荷兰格罗宁根大学高分辨率cryo-EM实验室助理教授Cristina Paulino在最近的一次采访中谈到,“虽然遗传学和生物化学有助于理解蛋白质的生理作用,但结构生物学揭示了这些纳米机器的外观以及它们的连接方式。”
因此,对这种“连接方式”的了解为科学家们提供了修复、设计和复制蛋白质,或潜在地阻断蛋白质功能的机会——蛋白质组学的应用,预计将成为个性化医学和现代药理学不可或缺的组成部分。
关于XL-MS技术应用
生物学的一个基本原理是蛋白质由氨基酸残基通过肽键连接形成多肽。除了肽键外,还存在非共价键,如范德华力、静电和疏水相互作用。在结构生物学中,这些键很难检测到,在原子水平上研究蛋白质结构时增加了额外的复杂性。在过去的十年中,蛋白质组学领域见证了MS技术逐渐增加丰富的一系列令人深刻的技术,其中。XL-MS技术是已证明对结构蛋白质组学不可或缺的技术之一。[1]
图1总结了典型XL-MS的工作流程,其中,蛋白质(或其邻近)之间的非共价键相互作用(或接近它们)通过用交联试剂溶解天然蛋白质转化为人工共价键。由于赖氨酸残基的广泛存在、在水溶液中的稳定性和高反应活性,赖氨酸残基的伯胺基团或蛋白质的N-末端是交联剂的常见靶标。最常用的是同位功能交联剂包括辛二酸二琥珀酰胺(DSS)和辛二酸(磺基琥珀酰亚胺基)。[2]在交联阶段之后,蛋白质被蛋白酶加工成肽段。
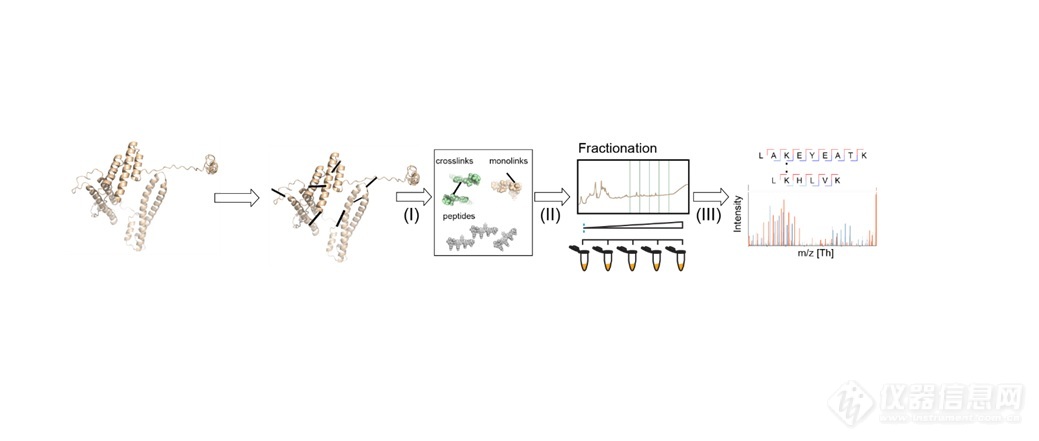
图1:通用XL-MS工作流程。图片来源:乌得勒支大学Heck实验室Richard Scheltema
“随后通过MS测量混合物进行鉴定——在大多数情况下,可以指定交联中涉及的氨基酸,用间隔臂的长度和两侧链的长度定义的距离进行约束” 乌特勒支大学Heck实验室Richard Scheltema博士解释说,“这些距离限制提供了关于蛋白质如何折叠(两种来自相同蛋白质的肽段)或蛋白质相互作用的有价值的信息,以及这种相互作用的界面位于何处(两种来自不同的蛋白质肽段)。”
通常情况下,XL-MS实现的结构分辨率在15-50埃米,其分辨率无法与X射线晶体学、核磁共振(NMR)光谱学、cryo-EM等其他结构生物学技术的分辨率相匹敌。因此,这些技术必须相互补充使用。[3]
cryo-EM:提供的进一步解决方案
冷冻电镜(cryo-EM)是由透射电镜(TEM)发展而来的,它通过二维(2D)图像投影来确定三维(3D)结构,同时保持样品的完整性和结构接近原始状态。这是通过研究玻璃化状态下的样品来实现的。在玻璃化状态下,样品的薄片迅速浸入液态乙烷溶液中,低温保存并保护其免受TEM内的真空和辐射损伤。[4]Paulino也进一步讨论了cryo-EM与其他结构生物学技术相比的优势。
近年来,cryo-EM技术已经取得了长足的进步,这意味着许多样品现在可以用近原子分辨率(通常为3-5埃)进行分析。[5]不幸的是,在这个分辨率范围内,科学家们仍然难以区分和表征蛋白质复合物中所有氨基酸侧链,这意味着重新构建模型是一项复杂的任务。“cryo-EM的使用正在大幅增加,从这项技术记录的蛋白质结构轮廓来看,很难确定哪些蛋白质相互关联,以及它们在整个结构中是如何排列的。而这就是XL-MS介入的地方。
XL-MS中的交联数据描述了肽段中两个特定氨基酸残基之间的最大距离。将提出的蛋白质结构模型及其结构域插入由cryo-EM重构获得的三维体中,并整合交联数据,以验证蛋白质复合物内特定肽的位置和方向。
将蛋白质整合到三维体中是一项艰巨而复杂的任务,需要对所涉及的蛋白质复合物及其子成分有透彻的理解。因此,Sali团队开发了集成建模平台(IMP),这是一个希望将XL-MS和cryo-EM结合起来的研究人员的通用工作流程平台。
XL-MS和cryo-EM在结构生物学中被配合应用
最近,Henry等人确定了载脂蛋白E4(ApoE4)的活性结构和结合机制。ApoE4与阿尔茨海默病(AD)和心血管疾病(CVD)有关,是载脂蛋白(ApoE)的脂质化同种型,ApoE是一种蛋白质,通过充当细胞表面受体的配体,促进富含胆固醇的脂蛋白的内化。采用结合XL-MS,cryo-EM和生物信息学建模工具的混合方法,Henry等表明ApoE4存在于两种不同的确证中,指向依赖于调节其受体结合区可及性的激活机制。作者指出,这些发现可能对于解释蛋白质在AD和CVD中的作用以及随后潜在治疗方法的发展具有重要价值。[6]
Schmidt和Urlaub在2017年全面综述中概述了类似的令人印象深刻的研究,包括Lührmann和Stark组对剪接体的结构表征。
2019年1月,荷兰科学研究组织(NWO)向一个名为“细胞中蛋白质社会行为的监测和可视化”的项目拨款160万欧元的资助,其中XL-MS和cryo-EM技术以及其他分子方法,被综合使用。项目可视化了蛋白质之间的相互作用,该项目的主要研究人员包括Albert Heck、John van der Oost、Alexandre Bonvin、Friedrich Foerster和Scheltema等人。
“在这个项目中,我们的目标是使用(一种cryo-EM的专门应用),在选定的一组嗜热菌中不偏倚地发现所有的蛋白质复合物。在这里,XL-MS被用来提供识别复合物内蛋白质的身份、空间顺序(通常不能直接从断层扫描数据中得到答案),以及结构模型来填补最终的空白。” Scheltema说,“之所以选择嗜热菌,是因为这些微生物是具有生物化学用途的蛋白质复合物的潜在宝库。”
重新定义限制,继续前进
总之,XL-MS和cryo-EM为结构蛋白组学领域提供了巨大的发展潜力。然而,每种技术都面临着自己的局限性,必须克服这些局限性才能形成完美的配合使用。
“Cryo-EM不断重新定义其局限性,但我们仍然面临着一些挑战,”Paulino评论道,“对于X射线晶体学来说,获得完全可操作和维护的同步加速器束流线基本上是免费的,而cryo-EM的高成本和操作显微镜所需要的专业知识水平便成为一个障碍。” 在一定程度上(但并非全部),政府实施对Cryo-EM设备的补贴政策的解决了这一问题。
“冷冻断层扫描提供了一种相对较低分辨率的蛋白质复合物视图,直接解释很困难。” Scheltema补充说,“另一方面,来自XL-MS的数据提供了解决方案中包含所有空间信息的视图。然而,我认为将这两者联系起来是最大的挑战,因为XL-MS提供了样本中所有蛋白质的信息, 这需要以某种方式过滤掉由断层扫描揭示的复合物内的蛋白质。”





