2019年7月5日,原清华大学颜宁(清华大学第一单位)等人Nature 在线发表题为“Modulation of cardiac ryanodine receptor 2 by calmodulin”的研究论文,该研究报道了RyR2的8个冷冻电子显微镜(cryo-EM)结构,它们共同揭示了不同形式CaM的分子识别特征,并提供了对CaM对RyR2通道门控的调节的见解。Apo-CaM和Ca2 + -CaM结合由手柄,螺旋和中心区域形成的细长裂缝中的不同但重叠的位点。RyR2上CaM结合位点的转变受Ca2 +与CaM结合而不是RyR2的控制。Ca2 + -CaM诱导各个中心结构域的旋转和域内移位,导致PCB95和Ca2 +激活的通道的孔闭合。相比之下,ATP,咖啡因和Ca2 +激活通道的孔在Ca2 + -CaM存在下保持开放,这表明Ca2 + -CaM是RyR2门控的许多竞争调节剂之一。
L型电压门控Ca2 +(Cav)通道由各种化合物调节,例如1,4-二氢吡啶(DHP),苯并硫氮杂卓(BTZ)和苯基烷基胺(PAA),其中许多已被用于表征通道性质和用于治疗高血压和其他疾病。2019年5月30日,颜宁(清华大学为第一通讯单位)及吴建平共同通讯在Cell 在线发表题为“Molecular Basis for Ligand Modulation of a Mammalian Voltage-Gated Ca2+ Channel”的研究论文,该研究报告了Cav1.1与拮抗药物硝苯地平,地尔硫卓和维拉帕米的复合物的冷冻电子显微镜(cryo-EM)结构,分辨率分别为2.9Å,3.0Å和2.7Å;Cav1.1与DHP激动剂Bay K 8644复合物的冷冻电子显微镜(cryo-EM)结构,分辨率为2.8Å。地尔硫卓和维拉帕米穿过孔域的中心腔,直接阻断离子渗透。尽管硝苯地平和Bay K 8644在重复III和IV的界面处占据相同的位点,但协调细节支持以前的功能观察。这些结构阐明了不同Cav配体的作用模式,并为结构引导的药物发现建立了框架。总之,结构研究阐明了三种临床应用的拮抗剂和原型激动剂在原子水平上识别和调节L型Cav通道的分子基础,并为大量实验和临床数据提供结构解释。这些结构为未来针对Cav通道病的药物发现奠定了基础。2019年5月24日,颜宁及龚欣共同通讯在Nature Communications在线发表题为“Inhibition of tetrameric Patched1 by Sonic Hedgehog through an asymmetric paradigm”的研究论文,该研究报告四聚体Ptch1与Sonic hedgehog(ShhNp)的棕榈酰化N-末端信号传导结构域的冷冻-EM结构,以4:2的化学计量比复合。该结构显示四个Ptch1被组织为二聚体的疏松二聚体,每个二聚体通过两个不同的抑制界面与一个ShhNp结合,一个主要通过ShhNp的N-末端肽和棕榈酰基部分,另一个通过ShhNp上的Ca2 +介导的界面。该结构阐明了Ptch1的四聚体组装,并提出了Hh配体的不对称作用模式,用于抑制Ptch1的潜在胆固醇转运活性。总之,与棕榈酰化ShhN以4:2化学计量比复合的四聚体Ptch1的结构进一步完成了Ptch1和Shh之间相互作用的分子图谱,为将来研究Hh信号传导设定了重要的框架。

心肌收缩是由Ca2 +进入细胞质引起的,最初来自细胞外环境,由Cav1.2介导,随后由肌浆网Ca2 +储存,由RyR2介导。 Ryanodine受体是已知最大的离子通道,由分子量大于2兆道尔顿的同源四聚体组成。超过80%的蛋白质折叠成多结构域,感知与各种调节剂的相互作用,从离子到蛋白质。 RyR2活性的精确调节对于每次心跳都是至关重要的, RyR2的异常活动与危及生命的心律失常相关。
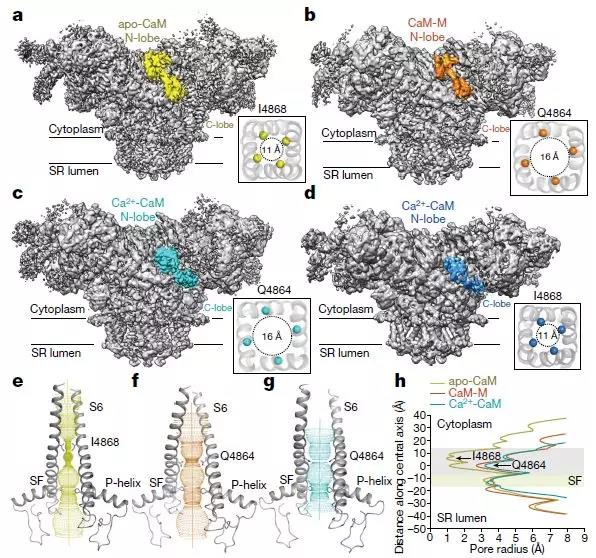
RyR2-CaM复合物的Cryo-EM结构
17kDa的CaM蛋白是一种重要的钙传感器,在大多数钙信号传导事件中起着重要作用。 CaM由大致对称的N-和C-末端叶组成,通过柔性铰链连接。每个叶可以通过两个EF-手(螺旋E和F-手)基序与两个Ca2 +离子配合,具有微摩尔范围的结合亲和力。在Ca2 +结合后,两个叶中的几个疏水残基的暴露促进CaM与靶序列的结合。 CaM与ryanodine受体直接相互作用,CaM-RyR的化学计量比为1:1,在纳摩尔范围的结合亲和力。
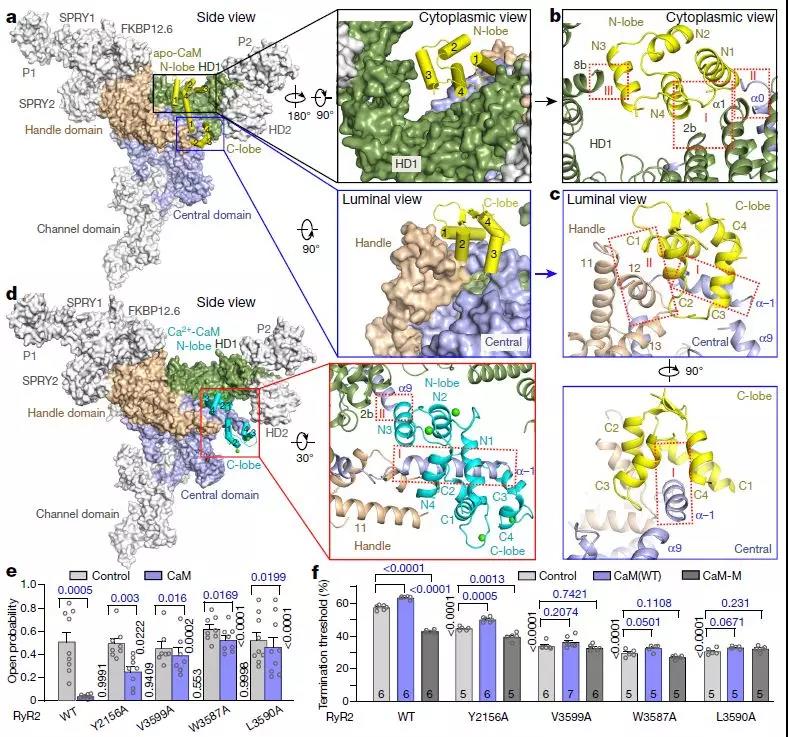
CaM和RyR2之间的接口
然而,CaM对ryanodine受体的调节是同种型特异性的。 CaM显示RyR1的双相调节,作为纳摩尔水平的Ca2 +(apo-CaM)的弱激活剂和微摩尔水平的Ca2 +(Ca2 + -CaM)的抑制剂。相反,apo-CaM对RyR2没有作用或抑制作用,而Ca2 + -CaM抑制RyR2。 CaM还被证明有助于终止存储过载诱导的Ca2 +释放(SOICR)。 CaM和RyR2之间的异常相互作用与心力衰竭相关,CaM-RyR2相互作用受损的纠正可以作为压力超负荷引起的心力衰竭致死性心律失常的治疗。
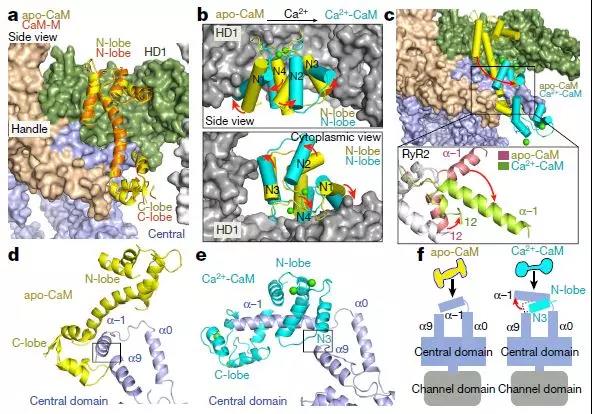
Ca2 +负载后CaM结合位点移位的分子基础
RyR-CaM复合物的结构表征局限于低分辨率电子显微镜图,其表明在RyR1中对于apo-和Ca2 + -CaM存在两个重叠但不同的结合位点。对应于RyR1的残基3614-3643(RyR2的中心结构域中的残基3581-3612)的肽结合apo-CaM和Ca2 + -CaM。与肽结合的Ca2 + -CaM的晶体结构揭示了肽的N和C末端的疏水锚,其分别容纳Ca2 + -CaM的C-和N-叶。
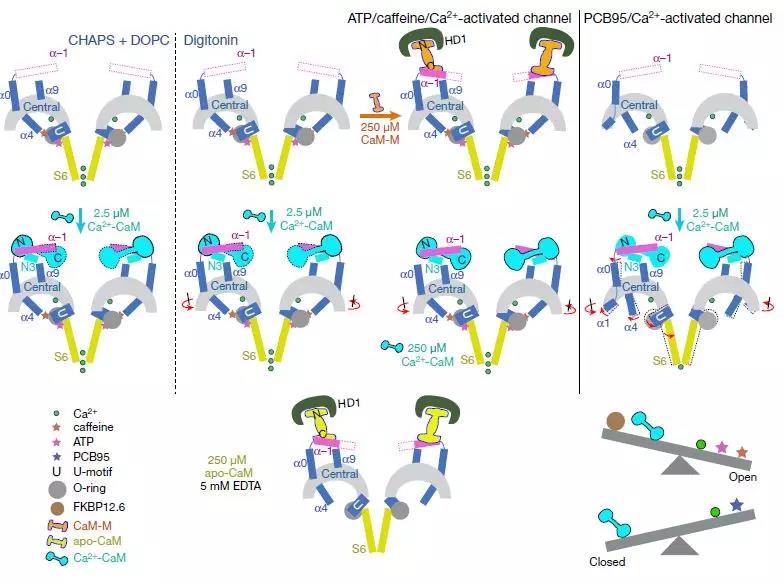
通过CaM调制RyR2的示意图
为了阐明CaM对RyR2的调节,该研究报道了RyR2的8个冷冻电子显微镜(cryo-EM)结构,它们共同揭示了不同形式CaM的分子识别特征,并提供了对CaM对RyR2通道门控的调节的见解。Apo-CaM和Ca2 + -CaM结合由手柄,螺旋和中心区域形成的细长裂缝中的不同但重叠的位点。RyR2上CaM结合位点的转变受Ca2 +与CaM结合而不是RyR2的控制。Ca2 + -CaM诱导各个中心结构域的旋转和域内移位,导致PCB95和Ca2 +激活的通道的孔闭合。 相比之下,ATP,咖啡因和Ca2 +激活通道的孔在Ca2 + -CaM存在下保持开放,这表明Ca2 + -CaM是RyR2门控的许多竞争调节剂之一。





