2019年7月15日,北京大学生命科学学院魏文胜课题组以长文形式在Nature Biotechnology杂志在线发表了题为“Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs”的研究论文,首次报道了名为LEAPER的新型RNA 单碱基编辑技术。与传统的核酸编辑技术需要向细胞同时递送编辑酶(如Cas蛋白)及向导RNA不同,LEAPER系统仅需要在细胞中表达向导RNA即可招募细胞内源脱氨酶实现靶向目标RNA的编辑。利用该技术,研究人员在一系列疾病相关基因转录本中实现了高效、精准的编辑,并成功修复了来源于Hurler综合征病人的α-L-艾杜糖醛酸酶缺陷细胞。该技术的建立为生命科学基础研究和疾病治疗提供了一种全新的工具。

使用工程核酸酶的基因组编辑技术,如锌指核酸酶-转录激活因子样效应核酸酶(TALENs)和CRISPR系统的Cas蛋白,已应用于操纵无数生物体中的基因组。最近,胞苷或腺苷脱氨酶已经与CRISPR-Cas9偶联,以产生可编程的DNA碱基编辑器,为纠正引起疾病的突变提供了新的机会。除DNA编辑外,还利用ADAR腺苷脱氨酶实现RNA的精确腺苷 - 肌苷编辑。已经在哺乳动物中鉴定了三种ADAR蛋白,即ADAR1(同种型p110和p150),ADAR2和ADAR3,其底物是双链RNA。
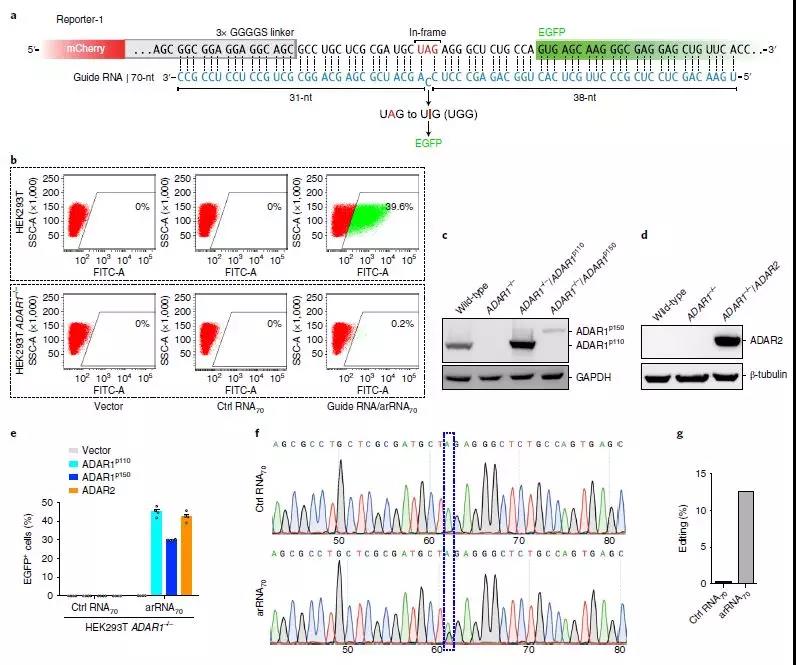
利用内源性ADAR1蛋白进行靶向RNA编辑
肌苷被认为在翻译期间模仿鸟苷(G)。为了实现靶向RNA编辑,将ADAR蛋白或其催化结构域与λN肽,SNAP-标签或Cas蛋白(dCas13b)和sgRNA以将嵌合ADAR蛋白募集到特定位点。或者,据报道,过量表达ADAR1或ADAR2蛋白以及携带R / G基序的gRNA也能够进行靶向RNA编辑。
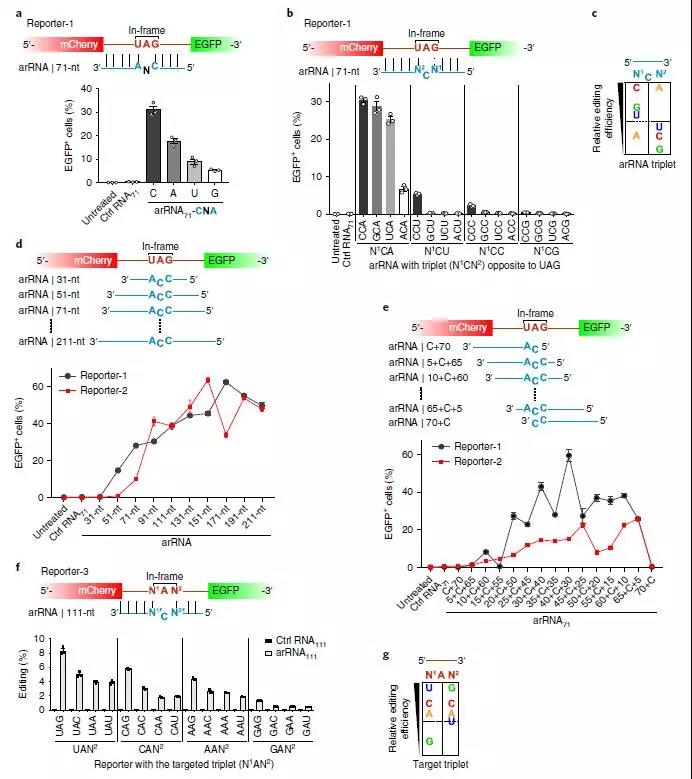
LEAPER的表征和优化
所有这些报道的哺乳动物系统中的核酸编辑方法依赖于两种组分的异位表达:酶和gRNA。尽管这些二元系统在大多数研究中有效地起作用,但一些遗传障碍限制了它们的广泛应用,特别是在治疗中。因为用于基因治疗的最有效的体内递送是通过病毒载体,并且非常理想的腺相关病毒载体在货物大小(~4.5千碱基)中受限,这使得容纳蛋白质和gRNA具有挑战性。最近报道ADAR1的过表达由于RNAs上的异常超编辑而赋予多发性骨髓瘤的致癌性并产生大量的全局脱靶编辑。同时,蛋白质或其非人类来源的异位表达具有引发免疫原性的潜在风险。此外,预先存在的适应性免疫和p53介导的DNA损伤反应可能损害治疗性蛋白质的功效,例如Cas9。
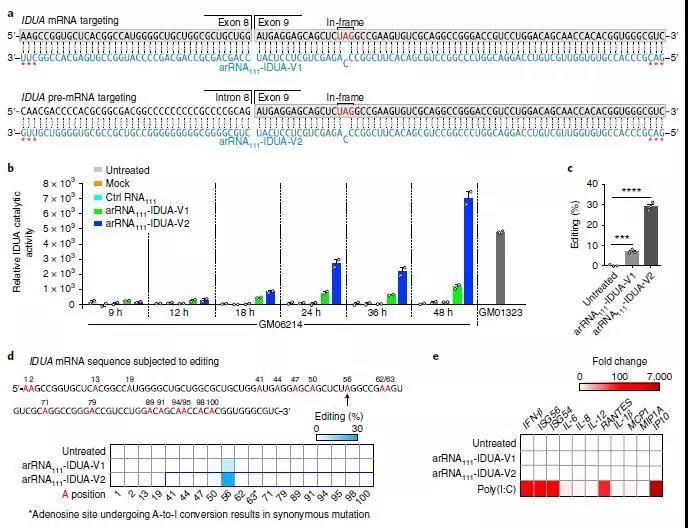
通过LEAPER恢复Hurler综合征患者来源的原代成纤维细胞中的IDUA活性
在这里,研究人员提出了一种方法,称为利用内源性ADAR进行RNA(LEAPER)的可编程编辑,该方法采用短的工程化ADAR招募RNA(arRNA)来募集天然ADAR1或ADAR2酶以将特定腺苷转变为肌苷。该研究显示由质粒或病毒载体或作为合成寡核苷酸递送的arRNA实现高达80%的编辑效率。LEAPER具有高度特异性,在目标区域具有罕见的脱靶和有限的非靶腺苷编辑。它在广谱细胞类型中具有活性,包括多种人原代细胞类型,并且可以在Hurler综合征患者来源的原代成纤维细胞中恢复α-L-艾杜糖醛酸酶催化活性,而不会引起先天免疫反应。作为单分子系统,LEAPER可实现精确,高效的RNA编辑,广泛适用于治疗和基础研究。
魏文胜

魏文胜 1969 年出生于江苏,1991 年获得北京大学生物化学学士学位,1999 年获得密西根州立大学遗传学博士学位,之后赴斯坦福大学医学院从事博士后研究,师从美国科学院院士 Stanley Cohen 教授。2005年起在斯坦福大学医学院短暂工作后,于 2007 年起在北京大学生命科学学院任研究员。目前同时担任北京大学生物医学前沿创新中心(BIOPIC)、北京未来基因诊断高精尖创新中心及北大 - 清华生命科学联合中心研究员。
魏文胜以通讯或第一作者发表了多篇包括Cell, Nature, Nature Biotechnology, PNAS等在内的高影响论文,共申请近 10 项发明专利,已获 4 项发明专利授权。获得包括谈家桢生命科学创新奖、中国专利优秀奖、科学中国人年度人物、郑昌学教学优秀奖、拜耳科学家奖、罗氏中国青年科学家奖、东宝生命科学奖等荣誉。
魏文胜课题组着重发展基因组编辑技术,特别是其在高通量功能基因组学方面的技术平台建设,用于基因、非编码 RNA 以及多种基因组调控元件的功能研究;同时结合表观修饰识别、动态成像等手段,研究癌症、感染等重大疾病发生发展的分子机制,为发展高效治疗手段提供新的药物靶点和思路。





