为了达到最佳灵活性和灵敏度,我们提供5X和10X浓度的naica® multiplex PCR MIX以降低MIX用量,从而使得更多的反应体积可供更多的模板、引物或探针的加入。

naica® multiplex PCR MIX可在naica®微滴芯片数字PCR系统的动态范围内对多个靶点进行同时定量,并保持良好线性。
采用0.2到13000cp/uL的DNA样本,使用10X naica® multiplex PCR MIX,在naica®微滴芯片数字PCR系统上进行三个靶点的同时检测(图1)。高浓度的PCR MIX(5倍和10倍浓度均可使用)可使样本输入体积最大化,从而提高低浓度样本中目标靶点的检测能力。
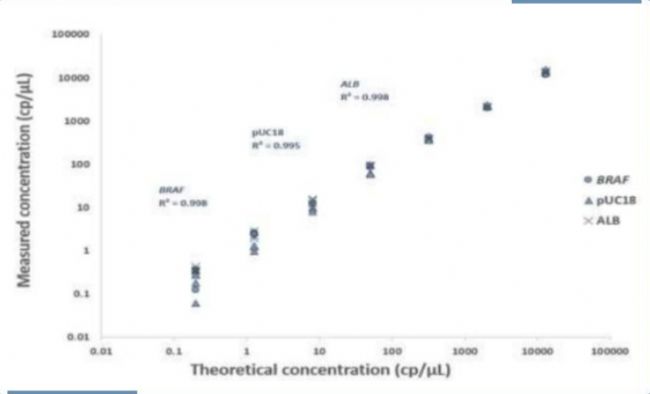
▲ 图1:使用naica® multiplex PCR MIX同时对3个靶点(BRAF、ALB和pUC18)进行线性定量。将人类基因组(hg)DNA和pUC18质粒进行连续稀释(0.2、1.5、8.0、50、320、2050和13000cp/uL),各稀释液进行3次重复检测。结果显示各靶点的线性关系好,R2均大于0.99,说明结果高度真实可靠。
在多重检测中可以对低浓度靶点进行稳定且灵敏的检测。
多重检测中多个靶点的共扩增比单个靶点的扩增更为复杂,可能会因为潜在的干扰和反应复杂性的影响,导致多重检测的线性范围降低。在naica®微滴芯片数字PCR系统上使用naica® multiplex PCR MIX分别进行3重和单重检测(图2),结果发现,不管是在高浓度的外部靶点(BRAF和ALB hgDNA)存在的情况下(图2A)还是在外部靶点不存在的情况下(图2B),两组实验中pUC18线性量化的动态范围一致,且阳性微滴和阴性微滴群组的荧光水平和可分性也高度一致。此外,不管是单重还是3重检测,pUC18靶点都能得到可靠的定量(图3),且检测范围和线性度一致。
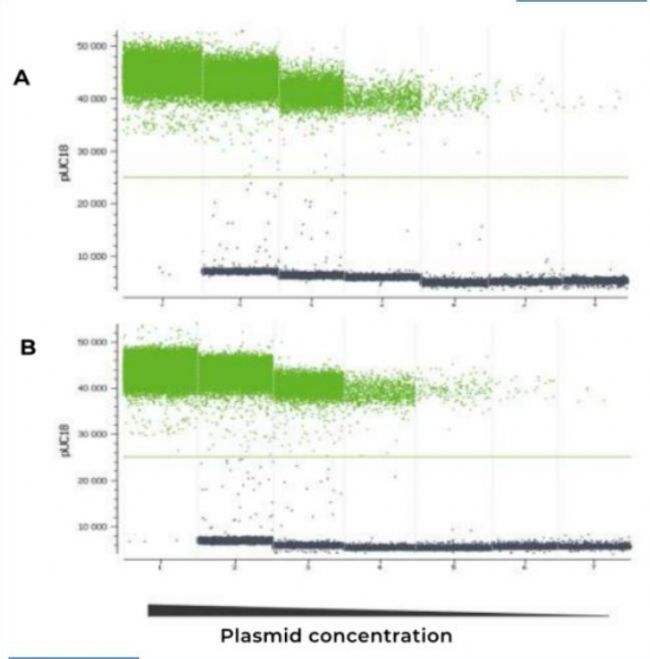
▲ 图2:使用naica® multiplex PCR MIX进行的3重和单重扩增的比较。将pUC18质粒的13000至0.2 cp/uL的系列稀释液在2个外部扩增靶点背景下(每个靶标为3000cp/uL,图A))和在不含外部靶点(图B)的情况下进行定量检测,3次重复。结果显示,3重和单重扩增中pUC18的检测结果高度一致。注:3重和单重的反应液中均含有pUC18、BRAF和ALB的特异性引物探针。
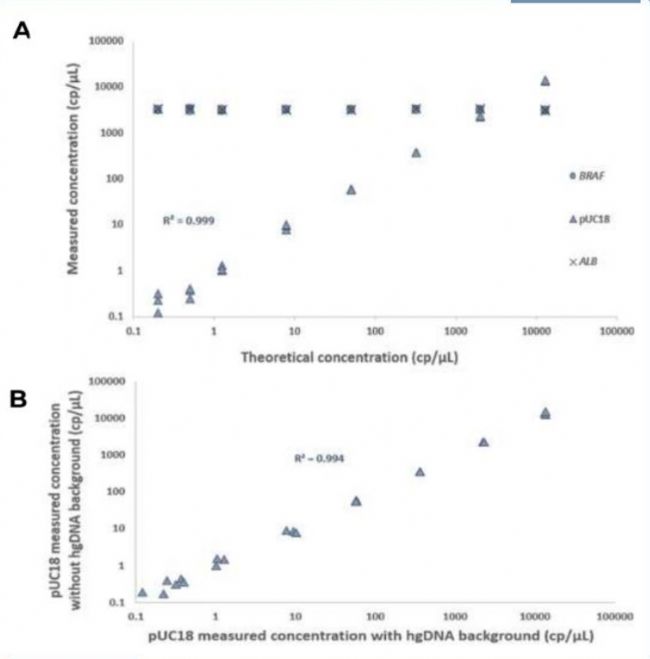
▲图3:使用naica® multiplex PCR MIX的扩增结果真实可靠。采用13000-0.2cp / uL的pUC18 DNA稀释液进行3重(A)和单重检测(B),各稀释液进行3次重复。(A) 3重反应中额外加入3000cp / uL(10ng)的hgDNA模板;(B) 单重反应中没有额外加入hgDNA模板。结果显示,3重和单重反应中,pUC18均能获得真实可靠的定量结果,同时检测范围和线性高度一致;3重反应中BRAF和ALB检测也具有良好的重复性,相对标准偏差在2.3-2.5%之间,n=21。





